O que esperar da Morfologia oocitária?
08 jul, 2024
As crescentes evidências de que a qualidade do óvulo interfere nos resultados em um
tratamento de fertilização in vitro têm impulsionado cada vez mais a busca por indicadores
que possibilitam estimar a sua capacidade de desenvolvimento (1). Além disso, sabemos
que ao estimular os ovários de maneira controlada, são recrutados tanto oócitos de boa
qualidade como aqueles que não iriam amadurecer sem o uso dos medicamentos
hormonais. A partir disso, é possível saber quais deles têm qualidade e potencial para gerar
um futuro embrião saudável?
Partindo do princípio de que a palavra morfologia significa o estudo da forma, a análise
morfológica é considerada um método não-invasivo, na qual se baseia na observação de
estruturas oocitárias externas ao citoplasma, como: zona pelúcida, espaço perivitelino,
forma dos oócitos, primeiro corpúsculo polar; e aspectos internos do citoplasma dos oócitos
(ooplasma) (2,4). Embora o uso de características morfológicas como preditores da
qualidade do óvulo seja controverso, esse sistema de classificação pode fornecer
informações importantes para a pré-seleção de óvulos com maior competência de
desenvolvimento e, portanto, pode maximizar o resultado do desenvolvimento embrionário
(1,5).
Mas você deve estar se perguntando: como consigo aplicar essas informações na prática?
Bem, de acordo com o consenso de Istambul, a morfologia ideal do oócito é a de uma
estrutura esférica envolvida por uma zona pelúcida uniforme, com um citoplasma
translúcido uniforme, livre de inclusões e um primeiro corpúsculo polar de tamanho
apropriado, conforme podemos observar na Figura 1 (3). A partir disso, conseguimos ter um
parâmetro e sinalizar quaisquer alterações que fugirem da normalidade.
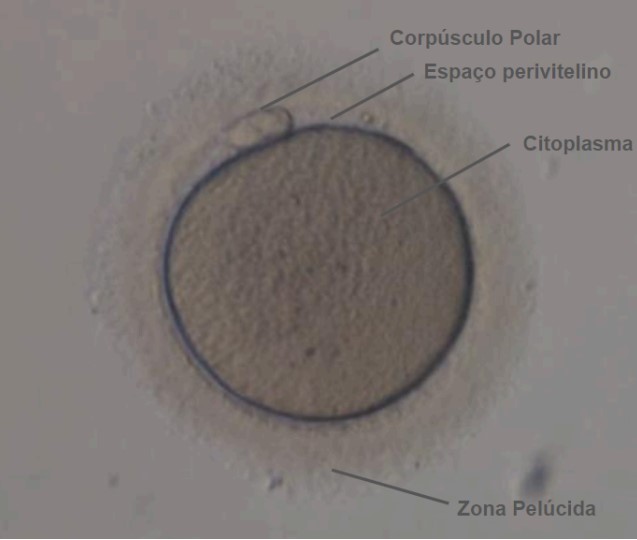
Figura 1 – Oócito maduro.
De acordo com Ozturk (2020), os oócitos de alta qualidade com base nas características
morfológicas observadas, possuíam taxas de fertilização, qualidade embrionária e gravidez
clínica mais altas do que os de baixa qualidade. Em contrapartida, sugere-se uma
diminuição das taxas de fertilização e formação de blastocistos quando há presença de
alterações no citoplasma como viscosidade elevada, espaço perivitelino aumentado e com
grânulos e primeiro corpúsculo polar fragmentado (1,2), como pode ser observado na figura
2.
Além disso, menores taxas de clivagem em oócitos “gigantes” e uma diminuição na
qualidade dos embriões formados e por consequência, menor taxa de implantação e
gravidez em óvulos com alterações citoplasmáticas como: presença de grânulos, inclusões,
vacúolos e aglomerados de retículo endoplasmático liso (2). Dito isto, há duas anomalias
que devem ser tratadas com um pouco mais de cautela: oócitos “gigantes” devido à sua
provável constituição genética anormal (presença de triploidias); e aglomerados de retículo
endoplasmático liso, devido a sua associação com perdas fetais (1,5)
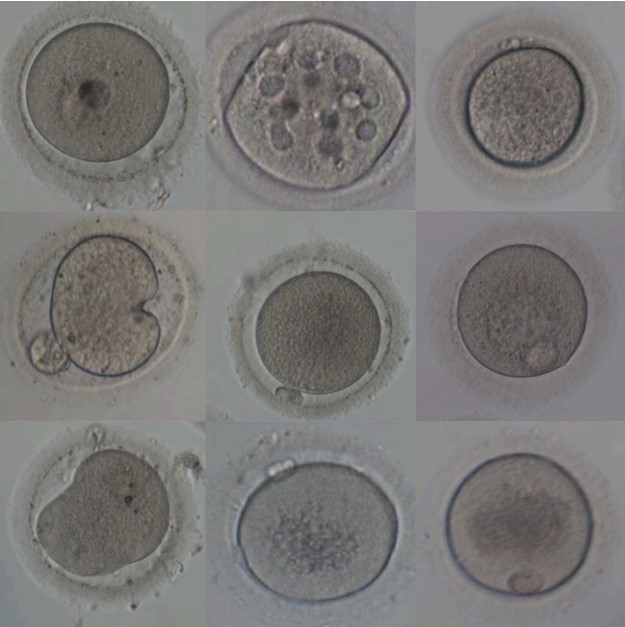
Figura 2 – Alterações morfológicas oocitárias.
No entanto, é importante ressaltar que essas alterações oocitárias até um certo nível, são
uma ocorrência normal e são notadas constantemente na rotina laboratorial. Algumas delas
podem ser, inclusive, indicadores de envelhecimento do óvulo ou da própria estimulação
ovariana (3). Mesmo assim, na maioria dos casos essas alterações não são impeditivas de
seguirmos com o tratamento, não excluem as chances de formação de embriões de
qualidade e tem chances sim, de conseguir o tão esperado resultado positivo.
Escrito por Luana Sarfatis
Embriologista sênior da clínica Engravida
Unidade São Paulo
Referências bibliográficas
(1) WANG, Qiang; SUN, Qing-Yuan. Evaluation of oocyte quality: morphological, cellular
and molecular predictors. Reproduction, Fertility And Development, [S.L.], v. 19,
n. 1, p. 1, 2007. CSIRO Publishing. http://dx.doi.org/10.1071/rd06103. Disponível em:
https://pubmed.ncbi.nlm.nih.gov/17389130/. Acesso em: 23 maio 24.
(2) OZTURK, Saffet. Selection of competent oocytes by morphological criteria for
assisted reproductive technologies. Molecular Reproduction And Development,
[S.L.], v. 87, n. 10, p. 1021-1036, 9 set. 2020. Wiley.
http://dx.doi.org/10.1002/mrd.23420. Disponível em:
https://pubmed.ncbi.nlm.nih.gov/32902927/. Acesso em: 23 maio 2024.
(3) MEDICINE, Alpha Scientists In Reproductive; EMBRYOLOGY, Eshre Special Interest
Group. Istanbul consensus workshop on embryo assessment: proceedings of an
expert meeting. Reproductive Biomedicine Online, [S.L.], v. 22, n. 6, p. 632-646,
jun. 2011. Elsevier BV. http://dx.doi.org/10.1016/j.rbmo.2011.02.001. Disponível em:
https://www.rbmojournal.com/article/S1472-6483(11)00105-2/fulltext. Acesso em: 27
maio 2024.
(4) LASIENË, Kristina et al. Morphological criteria of oocyte quality. Medicina (Kaunas),
Lithuania, v. 7, n. 45, p. 509-515, jul. 2009. Disponível em:
https://pubmed.ncbi.nlm.nih.gov/19667744/. Acesso em: 23 maio 2024.
(5) BRAGA, Daniela Paes Almeida Ferreira; SETTI, Amanda S.; FIGUEIRA, Rita de
Cássia S.; MACHADO, Rogério Bonassi; IACONELLI, Assumpto; BORGES, Edson.
Influence of oocyte dysmorphisms on blastocyst formation and quality. Fertility And
Sterility, [S.L.], v. 100, n. 3, p. 748-754, set. 2013. Elsevier BV.
http://dx.doi.org/10.1016/j.fertnstert.2013.05.021. Disponível em:
https://pubmed.ncbi.nlm.nih.gov/23768986/. Acesso em: 27 maio 2024.
