Quando a biópsia não dá certo, de quem é a culpa?
26 maio, 2022

Os primeiros ciclos de diagnóstico genético pré-implantacional (PGD) datam do final de 1989. Em um grupo de casais que possuíam risco de doença ligada ao cromossomo X , a biópsia foi realizada em embriões que se encontravam na fase de clivagem (terceiro dia, 6-8 células). A biópsia pode ser realizada, teoricamente, em qualquer estágio de desenvolvimento embrionário, e se faz necessário o rompimento da zona pelúcida para possibilitar a retirada do material para análise .
Apesar de ser uma técnica muito bem conhecida pelos embriologistas, alguns cuidados devem ser tomados para se obter o esperado, mesmo que o resultado não seja um embrião euploide. Dentre essas considerações, podemos citar a realização da ICSI – para assim evitarmos a contaminação paterna derivada da presença de espermatozoides aderidos à zona pelúcida, ou espermatozoides não descondensados dentro dos blastômeros, que pode acontecer quando realizamos a FIV convencional; outro cuidado é a total remoção das células do cumulus – células estas que visualizamos quando realizamos a aspiração folicular -, pois a presença dessas células pode contaminar o diagnóstico.
No momento da realização deste procedimento, o embriologista responsável deve estar com toda a sua atenção e cuidado voltados para a identificação do embrião na placa (cada laboratório pode definir seu protocolo: se serão realizadas placas individuais para cada embrião ou se será preparada uma placa com diversas microgotas, uma para cada embrião a ser biopsiado), as iniciais da paciente, o número do embrião biopsiado nos tubos que serão enviados para análise e checagem dos embriões em que iremos realizar a biópsia – todos parâmetros que devem ser checados duplamente para que os resultados sejam confiáveis.
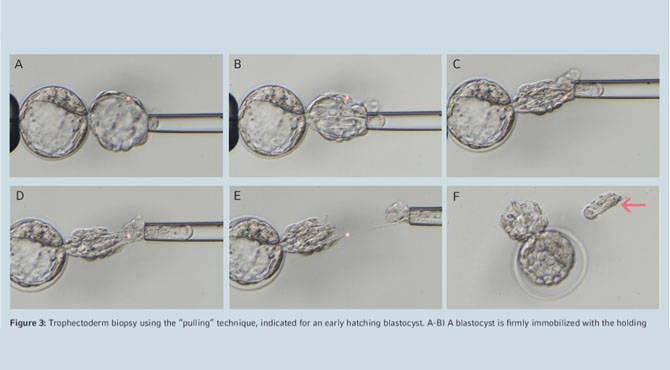
Outro cuidado é avaliar bem em qual fase de desenvolvimento embrionário será realizada a biópsia e analisar se o embrião se encontra no estágio de desenvolvimento ideal para tal. Atualmente, as biópsias mais amplamente realizadas são as de blastocisto (biópsia de trofectoderma), que se tornou mais viável pela evolução dos meios de cultura e novas tecnologias para a melhora do cultivo embrionário mais prolongado (até o sétimo dia, em alguns casos). A vantagem de realizar a biópsia na fase de blastocisto é que ela fornece uma maior quantidade de células para análise genética, reduzindo as chances de termos resultados nos quais não foi possível amplificar o DNA, e evitando também dano ao embrião.
Outro fator importante é o momento ideal para se realizar o hatching – a abertura na zona pelúcida do embrião com a ajuda do laser. Essa abertura pode ser realizada no terceiro, quarto ou na manhã do quinto dia mas, mais uma vez, quem irá determinar o melhor momento será o embriologista que realizará a biópsia, pois é quem terá todas as ferramentas para avaliar o estágio de desenvolvimento ideal para que o hatching seja realizado e, posteriormente, a biópsia. Quando as células do trofectoderma “herniarem”, ou seja , saírem de dentro da zona pelúcida após o hatching, é realizada a remoção destas com a ajuda do laser em alguns pontos de contato celular, ou excisão mecânica. A retirada desse material requer muito cuidado para não retirarmos pouco, o que poderia prejudicar a amplificação do DNA. As células da massa celular interna (que dará origem ao o feto) não são afetadas pela remoção das células do trofectoderma, se o procedimento for bem realizado e a avaliação da morfologia do embrião tiver sido bem feita. Após a biópsia, o embrião será congelado e a amostra retirada será enviada para o laboratório de genética para que a amplificação do DNA seja realizada. Centros de reprodução assistida que se encontram nas mesmas cidades que o laboratório que realiza a análise genética podem receber os resultados em até 24 horas, possibilitando assim a transferência a fresco, caso seja da vontade do casal e do protocolo médico.
Outro ponto que não pode ser esquecido é o real motivo da realização da biópsia: a indicação, a necessidade de ser realizada e qual a análise genética que melhor se aplica ao casal (testes para aneuploidias, testes monogênicos, testes para análise de translocações). Todos esses pontos devem ser muito bem discutidos com o médico e, caso necessário, com um geneticista, e podem ser reavaliados durante o tratamento.
A análise genética embrionária pode não melhorar os resultados para a população em geral, mas melhora as taxas de nascimento quando realizadas no estágio de blastocisto em embriões de mulheres acima dos 35 anos de idade.
A biópsia de trofectoderma é um método invasivo e auxilia na melhor seleção embrionária, podendo aumentar as taxas de implantação e gravidez e o número de nascidos vivos. Contudo, essa técnica requer um time altamente treinado e capacitado de embriologistas, já que é um procedimento muito complexo e invasivo. O surgimento de uma nova técnica não invasiva, chamada niPGT-A – na qual uma fração do material genético do embrião pode ser encontrado no meio de cultura e pode ser prontamente isolado, sequenciado e analisado – pode ser uma alternativa, já que não necessita de um time de embriologistas altamente treinados. Podemos voltar a esse assunto em um outro momento.
O que devemos compreender é que, devido à natureza delicada desse procedimento, tanto o paciente quanto o médico e o embriologista devem estar cientes de que, se algo der ou deu errado, antes de tentar achar um culpado devemos reavaliar se todas as etapas durante o processo foram bem observadas, se estávamos capacitados para tal procedimento, se o embrião possuía a morfologia adequada para a realização da biópsia e congelamento, se a clínica possuía todas as ferramentas disponíveis para a realização da biópsia e, no final das contas, se realmente havia a necessidade deste procedimento, evitando assim o desgaste emocional de todos os envolvidos.
Ivana Rippel Hauer
#blastocist #embryobiopsy #pgt-a
Reprodução Assistida – Técnicas de laboratório – Primeira Edição 2017 Capítulo 19.
PGT-A: who and when? Α systematic review and network meta-analysis of RCTs.
Simopoulou M, Sfakianoudis K, Maziotis E, Tsioulou P, Grigoriadis S, Rapani A, Giannelou P, Asimakopoulou M, Kokkali G, Pantou A, Nikolettos K, Vlahos N, Pantos K.J Assist Reprod Genet. 2021 Aug;38(8):1939-1957. doi: 10.1007/s10815-021-02227-9. Epub 2021 May 25.
