Parâmetros morfológicos oocitários interferem na formação e morfologia do blastocisto?
17 set, 2024
A resposta parece fácil, afinal qualquer parâmetro que foge do habitual poderia gerar uma desordem, mas no caso do gameta feminino apresenta-se uma gama de variações, alguma leves e outras que implicam em sérios desfechos. Avaliar morfologicamente oócitos para predição do desenvolvimento embrionário é um procedimento rotineiro, não invasivo e pode aumentar a eficiência global dos tratamentos de reprodução assistida. Claramente a qualidade do oócito pode afetar a qualidade do desenvolvimento embrionário, mas quais são os limites? A análise morfológica é considerada crucial em países onde fatores legais, sociais ou religiosos restringem a produção de embriões excedentes. Impreterivelmente após a denudação das células da granulosa que envolvem o complexo cumulus-oophorus e antes dos processos de vitrificação oocitária ou ICSI, essa avaliação é realizada através de um microscópio invertido, permitindo assim a checagem da maturação nuclear e a presença dos dimorfismos oocitários intra e extracitoplasmáticos.
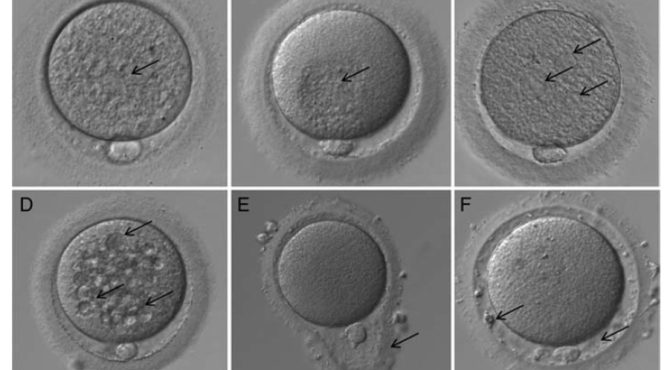
A morfologia do oócito maduro é caracterizada pela forma esférica, com média de diâmetro de 120um, citoplasma claro e uniforme, um único corpo polar, zona pelúcida de espessura apropriada e uniforme e espaço perivitelino de tamanho adequado, quando o citoplasma do oócito está em contato com a zona pelúcida na maior parte de seu perímetro. Importante pontuar que a maturação nuclear e citoplasmáticas podem ser eventos que não são equivalentes e nem sincrônicos. As alterações intracitoplasmáticas são mais comuns de serem encontradas, podemos citar a granulação citoplasmática difusa, inclusões ou corpos refrateis (lipofusina) e zona necrótica (área central granular no citoplasma) e extra-citoplasmática, a fragmentação do corpúsculo polar. As anormalidades menos observadas (fig.1) incluem presença de agregados do reticulo endoplasmático (SER), vacúolos, espaço perivitelino aumentado com grânulos, forma oocitária ovalada ou irregular do oócitos, zona pelúcida espessa, coloração escurecida do oócito, corpúsculo polar degenerado, pequeno, aumentado, múltiplo ou hialino.
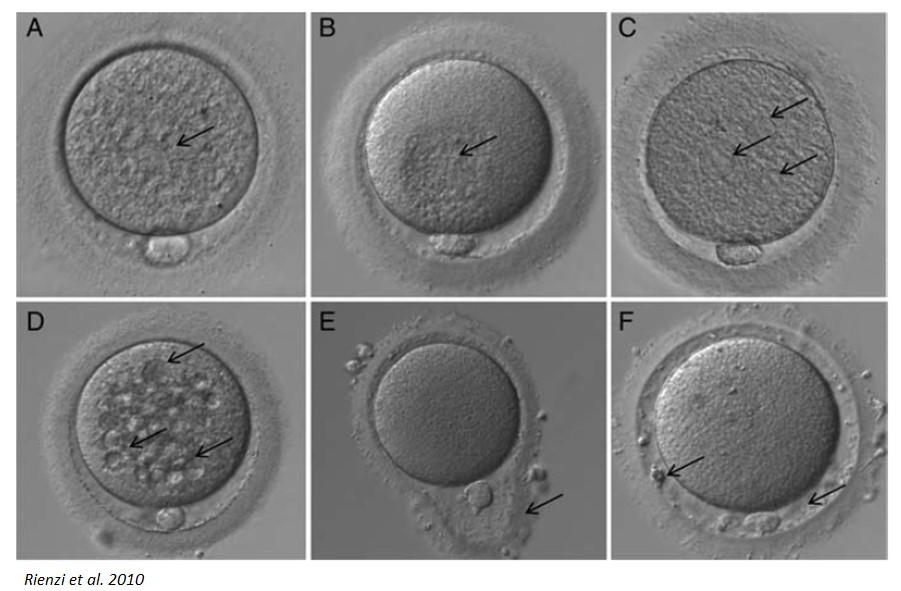
Figura 1: Diferentes anormalidades morfológicas de oócitos humanos (setas) observadas por microscopia de luz (ampliação de 400×): (A) granulação citoplasmática difusa, (B) zona necrótica, (C) reticulo endoplasmático liso (SER), (D) vacúolos, (E) alteração de forma da zona pelúcida e (F) grânulos/fragmentos no espaço perivitelino.
Para realizarmos uma comparação dos dimorfismos oocitário e a formação de blastocisto ou o potencial de gestação desses embriões, podemos considerar o Consenso de Instanbul que concentra revisões bibliográficas e meta-analises publicadas durante essas últimas décadas.
Avaliando os dimorfismos
No caso das características da zona pelúcida e espaço perivitelino, as evidências não são suficientes para apoiar qualquer prognóstico negativo sobre a alteração dessa estrutura ou espessura, correlacionando o desenvolvimento embrionário. O corpúsculo polar aumentado pode estar associado à configuração anormal do fuso meiótico e merecer mais atenção, porém quando se apresenta fragmentado, não está relacionado à subsequente qualidade do embrião, desenvolvimento do blastocisto, taxas de implantação ou aneuploidias.
Quando avaliado a forma estrutural irregular do oócito, não existe correlação com parâmetros baixos de desenvolvimento e morfologia embrionária, porém existe uma associação nos casos de oócitos ovais. Como a dimensão entre os blastômeros é maior nesses ovoides, o contato máximo entre as células não ocorre, havendo atrasos dos parâmetros iniciais de desenvolvimento, principalmente nas fases de 4-células, ocasionando atrasos na compactação e formação do blastocisto. Oócitos gigantes (>180um) devem ser desconsiderados devido a possibilidade de tetraploidia, formação gerada provavelmente a partir da fusão de dois oócitos primordiais. Por outro lado, quando coletamos um complexo binovular, dois oócitos grudados, de tamanho normal, estes demonstram ter potencial de desenvolvimento embrionário de boa qualidade e com capacidade de implantarem e desenvolvimento fetal normal.
Oócitos com granulação central foram associados à baixa qualidade embrionária, diminuição da sobrevivência após congelamento e comprometimento da competência de desenvolvimento do embrião, porém meta-analises e outros estudos consideram esta estrutura de zona necrótica uma atividade normal que os oócitos podem apresentar e por este motivo as evidencias são insuficientes para apoiar um prognóstico negativo quando um oócito apresenta esse dimorfismo. Os corpos refráteis existentes são acúmulos de lipídios e apresentam uma cor castanho-dourado típica da lipofucsina e podem estar relacionados a idade da a mulher, mas não a baixa formação ou morfologia de blastocistos. Alta viscosidade citoplasmática foi associada a uma diminuição significativa nas taxas de fertilização (Ashrafi et al., 2015).
Os vacúolos são estruturas com membrana, translucidas e cheia de liquido, podendo aparecer de forma única ou em maiores números, podendo ter diferentes origens, inclusive após-ICSI. Vacúolos maiores que 25um podem distorcer a estrutura a citoesquelética e atrapalhar a sinalização dos gametas, diminuindo as taxas de fertilização e comprometendo o desenvolvimento embrionário. Os vacúolos que persistirem após a ICSI podem desaparecer ou se manter nas estruturas do blastocisto e presentes na massa celular interna deve receber uma atenção especial (Figura 2). Outra estrutura com maior atenção seriam os agregados do reticulo endosplasmáticos (discos de SER) que podem aparecer em 7% dos casos. Dados demonstram claramente que os embriões derivados de oócitos com SER estão associados ao risco de resultados graves e significativamente anormais. É recomendado que oócitos com essa característica não sejam usados para injeção.
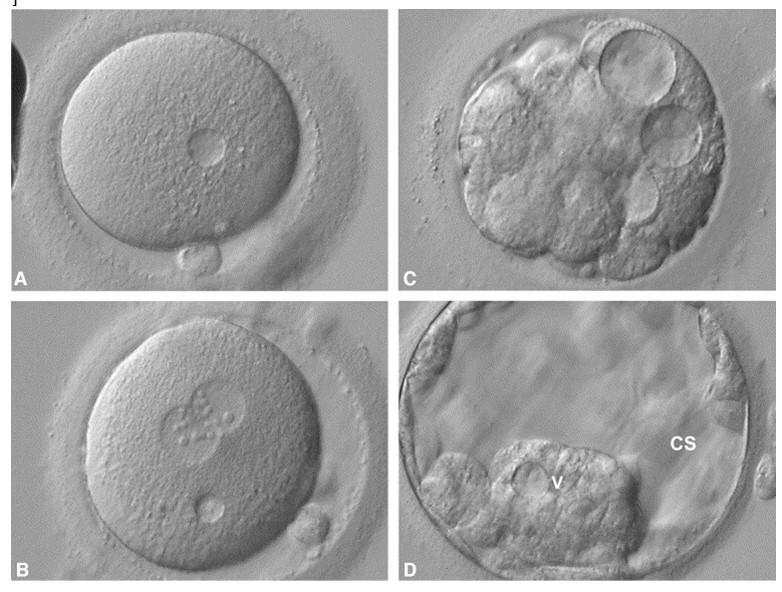
Figura 2: Presença da alteração intracitoplasmática: vacúolo. (A) D0, presença de um vacúolo de 18 mm no citoplasma oocitário, realizada ICSI; (B) D1, fertilização normal com a presença de dois pronúcleos (presença do vacúolo); (C) D4, embrião compactando com a presença de vacúolos; (D) D5, blastocisto expandido com a presença de vacúolo (v) na região da massa celular interna. CS: citoplasmatic strings (pontes citoplasmáticas).
No geral, dismorfismos individuais podem não estar fortemente associadas à viabilidade e competência do desenvolvimento unidos aos resultados clínicos. No entanto, é possível que a ocorrência de duas ou mais dessas características juntas exerçam uma influência negativa nos resultados.
A reprodução assistida passou por um estimulante desenvolvimento nos últimos anos, porém ainda fornece ajuda limitada para os resultados da gravidez em mulheres com idade materna avançada. Quando falamos em qualidade oocitária, as análises de PGT-A podem auxiliam na seleção de embriões cromossomicamente saudáveis. Estudos recentes apoiam o papel do encurtamento dos telômeros no envelhecimento reprodutivo de mulheres, e pode prever a fragmentação de embriões em desenvolvimento ou a euploidia de blastocistos (Keef et.al., 2015).
Há uma tendência geral de desconsiderar a morfologia oocitária ao selecionar um embrião ou blastocisto para transferência, seja este pelo cultivo em grupo ou pelo alto valor preditivo de gestação clínica das avaliações morfocinéticas na formação embrionária em incubadoras de time-lapse. Segundo alguns autores, o fenótipo adulto é consideravelmente definido pela qualidade dos oócitos dos quais são derivados (Mtango, et al., 2008). Acompanhamento de bebês, nascidos de oócitos com fenótipos atípicos demanda atenção.
A qualidade dos oócitos não é apenas determinada pelo genoma nuclear e mitocondrial, mas também pelo extra e microambiente ovariano e pelo folículo pré-ovulatório que podem trazer modificações durante o processo de transcrição do DNA e tradução das proteínas. A qualidade dos oócitos pode ser afetada por vários fatores, incluindo estilo de vida e o fator de infertilidade. Devido ao quadro complexo de variáveis, é altamente improvável que um único fator, característica morfológica ou mecanismo possa indicar adequadamente a competência de um óvulo. As abordagens modernas em desenvolvimento usadas para avaliar a qualidade do oócito e prever o sucesso reprodutivo incluem avaliação genômica, proteômica e inteligência artificial. Novas plataformas de machine learning estão imergindo na análise morfológica de oócitos com alto valor preditor das fases de fertilização e formação de blastocistos. Plataformas com esse foco podem auxiliar mulheres e médicos na decisão da realização de mais ciclos nos casos de preservação de fertilidade e auxiliar no desempenho de bancos de óvulos doados.
Renata Erberelli
Biomédica pela UMESP
Coordenadora de Embriologia da Huntington Vila Mariana
Especialista em Biologia da Reprodução e Desenvolvimento/UNIFESP
Doutoranda no Departamento de Ginecologia/UNIFESP
Diretora Grupo de Interesses PRONUCLEO
Instagram:@embrio_ivf

-
Compartilhe
