Quais parâmetros morfológicos oocitários interferem na formação de blastocistos?
27 mar, 2023
Por Natália Prates
A estimulação ovariana controlada recruta tanto oócitos de boa qualidade como oócitos que nunca amadureceriam sem o uso de hormônios externos. Consequentemente, nós embriologistas, temos que lidar com gametas de características morfológicas variadas. Dito isso, vale ressaltar que o dismorfismo citoplasmático ou múltiplas anomalias morfológicas oocitárias podem afetar negativamente o potencial de formação de blastocistos (1,2).
Vários fatores podem ser responsáveis pela variação na taxa de formação de blastocistos. Considerando o papel fundamental do oócito no processo de desenvolvimento, a identificação não invasiva de dismorfismos oocitários antes da fertilização deveria ser extremamente útil na predição da taxa de formação de blastocisto. Porém, apesar de um número crescente de estudos com animais reforçar a ideia de que falhas recorrentes em reprodução assistida poderiam ser explicadas pela baixa qualidade oocitária, estudos com oócitos humanos ainda são escassos (3).
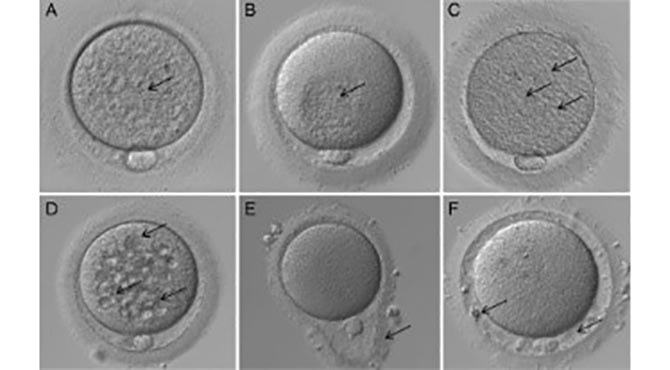
Oócitos maduros (MII) de boa morfologia devem apresentar: forma esférica, citoplasma claro e homogêneo, espaço perivitelino (EPV) pequeno, primeiro corpúsculo polar (CP) intacto e zona pelúcida clara e de espessura adequada. Já as alterações morfológicas podem ser subdivididas em citoplasmáticas e extracitoplasmáticas. As primeiras incluem a presença de granulosidade, agregados de retículo endoplasmático liso (SER), vacúolos e inclusões, como corpos refráteis. Alterações extracitoplasmáticas constituem irregularidades no EPV, na cor e espessura da zona pelúcida e formato do oócito (Fig. 1). Entretanto, dismorfismos oocitários, até um certo nível, são uma ocorrência normal. Porém, sugere-se que alguns deles possam refletir defeitos intrínsecos que poderiam afetar a competência oocitária (4).
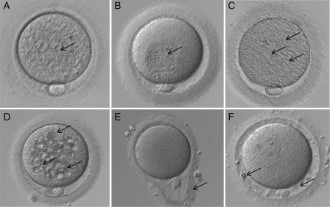
Ebner et al., encontraram um valor prognóstico positivo relacionando um corpúsculo polar intacto e homogêneo com taxa de fertilização e qualidade embrionária, assim como, taxa de implantação e gestação (4). Porém, uma diversidade de estudos e suas conclusões sobre a morfologia do CP sugere que esse ainda é um critério controverso para acessar a qualidade oocitária (5). Contudo, foi definido no Consenso de Istambul que oócitos com CP gigante não devem ser inseminados, devido ao risco de aneuploidia oocitária (2).
Estudos sobre o EPV enfatizam que critérios como seu tamanho e conteúdo são subjetivos e não padronizados, mas que é preferível utilizar oócitos com EPV pequeno e sem granulação. Outro estudo sugere que a presença de grânulos no EPV pode estar relacionada a absorção de gonadotrofinas e que poderia ser um fenômeno fisiológico da maturação sem uma relação direta com taxas de fertilização, clivagem ou qualidade embrionária (5).
Não existe consenso com relação a avaliação da zona pelúcida. Somente alterações morfológicas drásticas (zona fraturada ou empty zona) foram consideradas inapropriadas para ICSI (6). A análise da zona pelúcida somente, não permite uma avaliação correta da qualidade oocitária. Com isso, recomenda-se combiná-la com a análise de outro critério (5).
O formato do oócito não é conhecido como um marcador de qualidade (5). Porém, foi reportado que embriões originados de oócitos gigantes tem maior probabilidade de apresentar triploidia por diginia (quando o conjunto extra de cromossomos é de origem materna), apesar do desenvolvimento in vitro poder ser normal (6).
Estudos são contraditórios com relação a alterações no citoplasma e qualidade oocitária. Somente alterações severas no citoplasma devem ser consideradas anormalidades e podem ser usadas para avaliar a qualidade oocitária, em associação a outros critérios (5). A viscosidade do citoplasma e a resistência da membrana citoplasmática no momento da ICSI foram analisadas em dois estudos que mostraram um efeito significante em alguns parâmetros analisados (fertilização, qualidade embrionária e taxa de formação de blastocistos) (6). Qualquer impacto no desenvolvimento pré-implantacional está intimamente correlacionado ao tamanho e número de anomalias. A única exceção é o agregado de SER, que é o pior dismorfismo observável, considerando as consequências reportadas, como perdas fetais e desordens de imprinting (2).
Assim sendo, a ocorrência frequente de parada de desenvolvimento embrionário, prévia ao estágio de blastocisto ou durante as primeiras semanas após a transferência, sugere a real possibilidade de que existem defeitos inerentes ao oócito que podem ter consequências desfavoráveis ao longo do desenvolvimento embrionário. Apesar disso, pouco se sabe sobre as origens, se, quando e como as características oocitárias podem perturbar o processo de desenvolvimento normal. Um entendimento de quais defeitos são mais aparentes do que reais e quais poderiam ter consequências importantes para um indivíduo concebido por FIV a partir de um oócito “dismórfico”, são questões fundamentais tanto para o intuito de seleção embrionária e oocitária, como para o entendimento da biologia do desenvolvimento normal dos últimos estágios da oogênese e dos estágios iniciais da embriogênese humana (2).
Referências:
- Yakin K, Balaban B, Isiklar A, Urman B. Oocyte dysmorphism is not associated with aneuploidy in the developing embryo. Fertil Steril 2007; 88(4): 811-816.
- Balaban B, Brison D, Calderon G, Catt J, Conaghan J, Cowan L, Ebner T, Gardner D, Hardarson T, Lundin K, Cristina Magli M, Mortimer D, Mortimer S, Munne S, Royere D, Scott L, Smitz J, Thornhill A, Van den Abbeel E. The Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting. Hum Reprod 2011; 26(6): 1270-1283.
- Braga D, Setti A, Figueira R, Machado R, Iaconelli A, Borges E. Influence of oocyte dysmorphisms on blastocyst formation and quality. Fertil Steril 2013; 100: 748-754.
- Ebner T, Moser M, Sommergruber M, Tews G. Selection based on morphological assessment of oocytes and embryos at different stages of preimplantation development: a review. Hum Reprod Update 2003; 9(3): 251-262.
- Lemseffer Y, Terret M-E, Campillo C, Labrune, E. Methods for Assessing Oocyte Quality: A Review of Literature.Biomedicines 2022; 10(9): 2184.
- Rienzi L, Vajta G, Ubaldi F. Predictive value of oocyte morphology in human IVF: a systematic review of the literature. Hum Reprod Update 2011; 17(1):34-45.
-
Compartilhe
